Vom 26. – 28. September fand nach Corona-Pausen wieder ein Kongress der European Society for Alternatives to Animal Testing in Linz statt. Endlich, nach zwei Jahren Coronabeschränkungen und zahllosen Meetings und Kongressen online, konnten sich (Nachwuchs)Forscher:innen, Vertreter:innen von Regulationsbehörden und NGOs wieder persönlich austauschen. Dr. Claudia Gerlach von SATIS war dabei und informiert in diesem Bericht über die Neuigkeiten zu tierfreien Forschungsmethoden, die für Studierende und Nachwuchswissenschaftler:innen relevant sind.
Die Nachwuchswissenschaftlerin Dr. Pauline Zamprogno von der Universität Bern ist eine der Preisträger:innen des Young Scientists Travel Awards, mit dem EUSAAT die Teilnahme von jungen Wissenschaftlern am EUSAAT-Kongress fördert. Sie berichtete über ein in-vitro Lungenfibrosemodell, das IPF (idiopathische pulmonale Fibrose)-on-a-Chip. Die IPF ist eine chronische, fortschreitende und schwere Lungenerkrankung. Vorhandene Maus und in-vitro-Modelle sind oft nicht in der Lage, die Auswirkungen von Medikamenten in klinischen Studien vorherzusagen. Das IPF-on-a-chip Modell ahmt einige wichtige Merkmale der Lungenfibrose in einem frühen und späten Stadium, in Bezug auf die zelluläre Zusammensetzung, der extrazellulären Matrix und der neuartigen biologischen Membran nach. Die vollständige biologische Natur macht das Modell zu einem vielversprechenden Instrument für die Arzneimittelforschung.

Das Schweizer Organs-on-Chip Unternehmen Alveolix berichtete über das AlveoliX Barrier-on-Chip System, das die Dynamik menschlicher Organbarrieren nachbildet. Menschliche Zellen werden auf jeder Seite einer ultradünnen porösen Membran kultiviert, als Mono-, Co- oder Multikulturen, einschließlich immunkompetenter Zellen. Die Differenzierung Zellen wird dann durch 3D-Bewegungen stimuliert. So konnten mit menschlichen primären Lungen- und Darmzellen dynamische Lungen- und Darmbarrieren auf Chips erzeugt werden (siehe Abb. 1), darunter auch ein Infektionsmodell mit dem Erreger von Lungenentzündungen. Das Lung-on-chip Modell bildet die Mikroumgebung der Lungenbläschen, insbesondere der Luft-Blut-Schranke, unter 3D-Atembewegung nach. Die fortschrittlichen in vitro Modelle ermöglichen Wirksamkeitsstudien und akute Toxikologie-Analysen und haben somit das Potenzial, unsichere Medikamente frühzeitig zu erkennen und Tierversuche zu reduzieren oder sogar zu ersetzen. In einer Einzelfallstudie mit einer Pharmafirma konnten die gleichen toxikologischen Effekte wie in Tierversuchen festgestellt werden. Außerdem gibt es viele neue Krebsmedikamente mit einer enorm hohen Spezifität für das Erkennen von menschlichen Tumorzellen, welche die Testung im Tier unmöglich macht. Auch in solchen Fällen kann die AlveoliX Technologie aushelfen.
Nachwuchswissenschaftlerin Tine Haesen von der Universität Bielefeld und dem Fraunhofer Institut für Toxikologie und Experimentelle Medizin in Hannover berichtete über humane präzisionsgeschnittene Lungengewebeschnitte als ein ideales ex-vivo Modell, das die bisherigen in-vitro und in-vivo Experimente überflüssig machen kann. Mit den Schnitten von Lungen bzw. Lungentumoren können verschiedene Immunzellen analysiert und Zielmoleküle für die Krebstherapie validiert werden. Die Gewebeschnitte bewahren die ursprüngliche mikroanatomische 3D-Architektur der menschlichen Lunge und gewährleisten den Verbleib aller Immunzellen in ihrer komplexen Mikroumgebung.
Das Schweizer Unternehmen InSphero stellte ein 3D-Leber-Mikrogewebe zur Vorhersage von Arzneimittel-induzierten Leberschädigungen vor. Diese sind eine der Hauptursachen für die Rücknahme bereits zugelassener Arzneimittel und stellen eine große Bedrohung für menschliche Patienten dar. Tierversuche können die Lebertoxizität von Arzneimitteln bei Menschen aufgrund der Speziesunterschiede nicht genau vorhersagen. Insphero entwickelte das 3D InSight™ Leber MPS (mikrophysiologische System), ein standardisiertes Hochdurchsatz-In-vitro-Modell auf Basis von drei menschlichen, in der Leber vorkommenden Leberzelltypen. Die 3D-Co-Kultur weist die wesentlichen strukturellen und funktionellen Merkmale der nativen Leber auf. Mit den sogenannten Leberspheroiden konnte die Wirkung 63 stark leberschädigender Medikamente sehr genau vorhergesagt werden, mit einer Sensitivität von 90,3 % und einer Spezifität von 81,3 %. Die Cokultur ist für 28 Tage vital und eignet sich für Langzeitversuchen bei geringen Dosen.
Ein weiteres vorgestelltes in-vitro Modell zur Vorhersage von Lebertoxizität ist das mikrofluidische Modell des deutschen Unternehmens Dynamik42. Die Forscher nutzen ein mikrofluidisches Organ-on-a-Chip Modell basierend auf menschlichen Blutgefäß-, Leber- und Immunzellen. Durch die Blutgefäß-ähnliche Struktur wird eine blutähnliche Substanz mit der entsprechenden Medikamentenkonzentration durchgeleitet. Mit dem Lebermodell konnte die Toxizität eines zurückgenommenen Medikaments reproduziert werden, die in Studien an Mäusen nicht ohne die Zugabe von entzündlichen Co-Stimuli nachweisbar war.
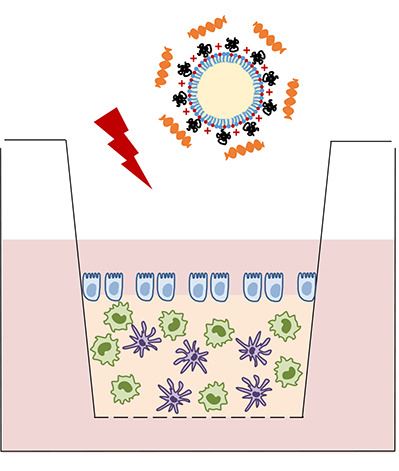
Dr. Brigitta Loretz vom Helmholtz Institut für Pharmazeutische Forschung, Saarland, berichtet über ein komplexes In-vitro-Modell der entzündeten Darmschleimhaut zur Erforschung neuer Arzneimittel. Das Modell ahmt die Pathophysiologie chronischer Darmerkrankung wie Morbus Crohn und Colitis ulcerosa nach. Die zahlreichen Mausmodelle haben aufgrund unterschiedlicher Organphysiologie und Krankheitsmanifestationen sowie Unterschiede in der Immunantwort nur eine geringe Aussagekraft für die menschliche Erkrankung. Das vorgestellte Durchlässige-Darm-(Leaky-Gut)-Modell verfügt über eine dysfunktionale Epithelbarriere und immunkompetente Zellen in einer physiologisch relevanten Mikroumgebung (siehe Abb. 2). Es ermöglicht Untersuchungen, zur Darmschranke sowie zur Wirksamkeit und der gezielten Verabreichung von Medikamenten und Trägermolekülen.
Die Arbeitsgruppe von Sascha Mendjan des Instituts für Molekulare Biotechnologie in Wien hat humane Herz-Organoide, sogenannte Kardioide, entwickelt, die die Entwicklung und Defekte des Herzens widerspiegeln. Die häufigste Ursache für den Tod von menschlichen Föten sind Fehler in der Herzentwicklung. Bisherige in-vitro-Modelle können nicht die spezialisierten Funktionen der verschiedenen Herzkompartimente erfassen. Mit den Kardioiden kann erstmals die Entwicklung der wichtigsten embryonalen Herzkompartimente mit in-vivo-ähnlichen Genexpressionsprofilen, Morphologien und Funktionen rekapituliert werden. Die Forscher können damit untersuchen, wie genetische und Umweltfaktoren Defekte im sich entwickelnden menschlichen Herzen verursachen.